Você está aqui
Resultados do estudo Duke ACT sobre sangue do cordão umbilical para o autismo: destaques para os pais
Introdução:
 Pesquisadores da Duke University estudam se infusões intravenosas de células-tronco do cordão umbilical podem ajudar crianças pequenas com transtorno do espectro do autismo (TEA). Os líderes deste grupo de pesquisa são a Dra. Joanne Kurtzberg e a Dra. Geraldine Dawson.
Pesquisadores da Duke University estudam se infusões intravenosas de células-tronco do cordão umbilical podem ajudar crianças pequenas com transtorno do espectro do autismo (TEA). Os líderes deste grupo de pesquisa são a Dra. Joanne Kurtzberg e a Dra. Geraldine Dawson.
Um estudo inicial (estudo da Duke ABC) desse grupo publicado em 2017 tratou 25 crianças de 2 a 6 anos com células-tronco de seu próprio sangue do cordão umbilical. Nesse estudo, aproximadamente 70% das crianças apresentaram melhora em um ou mais sintomas principais do autismo. É importante ressaltar que crianças com QI não-verbal (NVIQ) acima de 70, apresentaram melhor resposta à infusão com o sangue de cordão, comparado às crianças com QI mais baixo.
Com base nessas descobertas, o grupo Duke realizou um segundo estudo (estudo Duke ACT) publicado no Journal of Pediatrics em maio de 2020. Este artigo destaca os principais resultados.
Desenho do estudo Duke ACT:
O estudo Duke ACT foi um estudo randomizado, duplo-cego, controlado por placebo, prospectivo, que testou se as infusões de sangue do cordão umbilical melhorariam os principais sintomas do autismo.
Para qualificar-se para o estudo, as crianças deveriam ter entre 2 e 7 anos de idade, um diagnóstico confirmado de distúrbio do espectro autista, ter como língua-mãe o inglês e não apresentar anomalias genéticas conhecidas. Os candidatos foram submetidos a um teste de função cognitiva administrado remotamente, projetado para incluir apenas crianças com QI não verbal acima de 70.
O estudo incluiu 180 crianças com autismo e as designou para três grupos de estudo.
- "AUTOLOGOUS". O grupo Autólogo do estudo incluiu 56 crianças que receberam uma infusão de células-tronco de seu próprio sangue de cordão umbilical em sua primeira visita a Duke. Na segunda visita, seis meses depois, essas crianças receberam uma infusão de placebo.
- "ALLOGENEIC". O grupo Alogênico do estudo incluiu 63 crianças que receberam uma infusão de células-tronco de sangue do cordão doado em sua primeira visita a Duke. O sangue do cordão doado foi selecionado para corresponder a pelo menos 4 dos 6 tipos de HLA da criança. Na segunda visita, seis meses depois, essas crianças receberam uma infusão de placebo.
- "PLACEBO". O grupo Placebo incluiu 61 crianças, que receberam uma infusão de placebo em sua primeira visita a Duke. O placebo foi uma infusão inerte projetada para parecer, sentir e até cheirar como uma infusão de sangue do cordão umbilical. Então, na segunda visita, seis meses depois, essas crianças receberam células-tronco do cordão umbilical. Metade das crianças do grupo placebo recebeu sangue de cordão autólogo na segunda visita, e metade recebeu alogênico.
Observe que todas as crianças deste estudo receberam células-tronco do cordão umbilical em algum momento, na visita inicial ou 6 meses depois. É por isso que é chamado de estudo cruzado. O estudo também foi um estudo "duplo-cego", porque nem as famílias, nem seus médicos sabiam a qual grupo de estudo cada criança pertencia. Os pesquisadores do estudo, que tinham essas informações, foram cuidadosos para garantir que os três grupos estivessem equilibrados, com crianças de mesma faixa etária e QI.
As crianças participantes do estudo viajaram para a Duke University com suas famílias e receberam suas infusões em ambiente ambulatorial. Cada família viajou para Duke três vezes: para a terapia inicial, para a segunda infusão 6 meses depois, e para uma visita de acompanhamento final, um ano depois de terem entrado no programa. Em cada uma dessas visitas, as crianças do estudo foram submetidas a uma bateria de testes de habilidades e realizaram exames de imagem de suas funções cerebrais.
Resultados do estudo:
Nenhuma crianças teve reação séria às suas infusões. Cerca de 5% das crianças no estudo apresentaram urticária, tosse ou chiado no peito após a infusão. Muitos dos participantes estavam ansiosos com a infusão, com cerca de 40% e 50% das famílias relatando sintomas psiquiátricos em seus filhos durante as primeiras semanas após a infusão.
Embora as crianças participantes do estudo tenham realizado uma grande bateria de testes, bem como exames cerebrais, o estudo foi projetado para que seu "objetivo primário" fosse uma única métrica: se a terapia com sangue de cordão umbilical melhorasse ou não a pontuação média do participante na Escala Adaptiva de Socalização e Comportamento Vineland-3 (VABS-3). Este objetivo final não foi atingido para o grupo de estudo como um todo. Observando todos os participantes dos três grupos, o estudo Duke ACT não mostrou benefício do sangue do cordão umbilical sobre o placebo na Escala de Socialização VABS-3. No entanto, houve algumas dificuldades inesperadas que enfraqueceram o desenho do estudo, explicadas abaixo na próxima seção.
O resultado positivo importante do estudo ACT foi que um subconjunto de crianças mostrou um benefício significativo da terapia do sangue do cordão contra o placebo, em várias métricas. Para as crianças mais velhas, com QI mais alto, foram observadas melhorias na escala de comunicação (VABS-3 Communication Scale), atenção (rastreamento ocular) e eletroencefalograma (EEG) para a conectividade cerebral. Além disso, a média composta de pontuações na socialização e comunicação mostrou melhorias semelhantes nos dois grupos que receberam a infusão de cordão umbilical (veja o gráfico abaixo).
Dificuldades de estudo:
O estudo Duke ACT encontrou algumas dificuldades que prejudicaram a capacidade do estudo em demonstrar um benefício da terapia do sangue do cordão umbilical.
O maior problema que o estudo ACT encontrou foi que os testes de QI administrados remotamente foram menos precisos do que o previsto. O estudo foi projetado para recrutar idealmente 180 crianças com QI não verbal acima de 70, e poderia ter sido eficaz se apenas 143 crianças atingissem o limiar de QI. Em vez disso, apenas 101 dos participantes do estudo tinham QI não verbal acima de 70. É por isso que os autores do estudo tiveram que examinar um subconjunto dos participantes para encontrar benefícios claros da terapia com sangue do cordão umbilical.
Outra dificuldade encontrada no estudo do ACT foi que as melhorias na pontuação entre as crianças do grupo “Placebo” foram maiores do que o previsto. Isso tornou mais difícil medir os benefícios do sangue de cordão umbilical versus placebo. Lembre-se de que a única diferença entre os grupos tratados e o Placebo é que as crianças do grupo Placebo receberam células-tronco do cordão umbilical 6 meses depois.
Conclusões e próximas etapas:
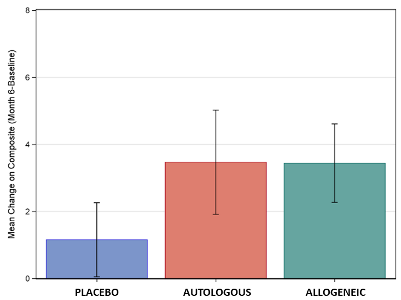 O gráfico demonstra a melhora média na pontuação composta de socialização e comunicação para os três grupos de tratamento, para o subconjunto de crianças de 4 a 7 anos com QI não verbal acima de 70. As linhas verticais exibem o desvio padrão em torno dessas médias. Foram observadas diferenças significativas entre o placebo e o sangue do cordão umbilical, mas esses escores não mostraram diferença entre os grupos que receberam sangue de cordão autólogo ou alogênico.
O gráfico demonstra a melhora média na pontuação composta de socialização e comunicação para os três grupos de tratamento, para o subconjunto de crianças de 4 a 7 anos com QI não verbal acima de 70. As linhas verticais exibem o desvio padrão em torno dessas médias. Foram observadas diferenças significativas entre o placebo e o sangue do cordão umbilical, mas esses escores não mostraram diferença entre os grupos que receberam sangue de cordão autólogo ou alogênico.
Os resultados deste estudo serão levados em consideração no planejamento de futuros ensaios clínicos e no que estão em andamento. Apenas as crianças que atingirem o limiar mínimo de QI durante os testes presenciais serão incluídas nos próximos estudos de autismo na Duke. Por enquanto, os ensaios clínicos devem ser restritos às crianças com QI mais alto, onde um benefício pode ser claramente comprovado. Outras alterações para estudos futuros serão aumentar o número de participantes para compensar as melhorias importantes vistas no grupo placebo e incluir nos objetivos finais de resultados, uma análise mais detalhada dos pontos que compõem a escala de socialização e comunicação VABS-3.
A Duke abriu recentemente um ensaio clínico de fase 2, randomizado, controlado por placebo, cruzado, testando células estromais mesenquimais do tecido de cordão umbilical (MSCs) para tratar o Transtorno do Espectro Autista. O estudo foi desenvolvido com base nas lições aprendidas do estudo Duke ACT. Serão incluídas 164 crianças, com idades entre 4 e 8 anos, com QI não verbal acima de 70.
O estudo ACT foi financiado pela Fundação Marcus. Todos os custos foram cobertos para os participantes. As famílias receberam ajuda de custo para as viagens para cada visita do estudo.
Esta tradução foi fornecida por: