Você está aqui
Restaurando a fertilidade feminina com tecidos do nascimento
 A terapia celular para restaurar a fertilidade é uma área ativa de pesquisa em alguns países. O Dr. Verter revisou 5695 ensaios clínicos de terapia celular avançada do banco de dados CellTrials.org cobrindo os anos de 2011 a 2020 e extraiu 112 ensaios que visam especificamente diagnósticos médicos que afetam a fertilidade. Os problemas masculinos incluídos são: disfunção erétil, distúrbio de Peyronie e baixa contagem de espermatozoides (azoospermia). Os problemas das mulheres englobavam insuficiência ovariana e vários distúrbios do revestimento uterino (endométrio), incluindo: endométrio fino, falha de implantação durante os ciclos de reprodução assistida, aderências intrauterinas e Síndrome de Asherman. Foram excluídos todos os distúrbios do trato urinário, masculino ou feminino.
A terapia celular para restaurar a fertilidade é uma área ativa de pesquisa em alguns países. O Dr. Verter revisou 5695 ensaios clínicos de terapia celular avançada do banco de dados CellTrials.org cobrindo os anos de 2011 a 2020 e extraiu 112 ensaios que visam especificamente diagnósticos médicos que afetam a fertilidade. Os problemas masculinos incluídos são: disfunção erétil, distúrbio de Peyronie e baixa contagem de espermatozoides (azoospermia). Os problemas das mulheres englobavam insuficiência ovariana e vários distúrbios do revestimento uterino (endométrio), incluindo: endométrio fino, falha de implantação durante os ciclos de reprodução assistida, aderências intrauterinas e Síndrome de Asherman. Foram excluídos todos os distúrbios do trato urinário, masculino ou feminino.
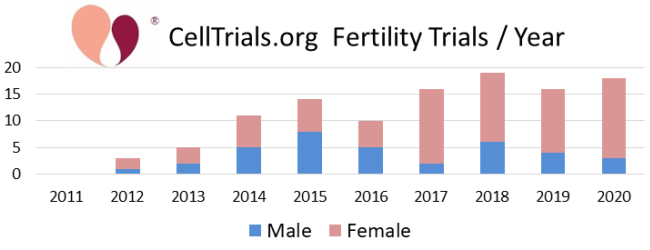
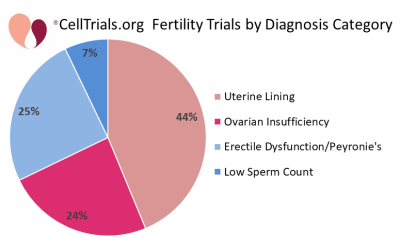
As duas primeiras figuras mostram como o conjunto completo de 112 ensaios se divide em termos de números por ano e à fração dedicada às principais categorias de diagnóstico.
 No restante deste artigo, vamos nos concentrar nos 49 ensaios clínicos registrados de 2011 a 2020 que empregaram a terapia celular para regenerar o endométrio de mulheres inférteis. Este campo deve sua projeção a um artigo provocativo publicado em 2004 que examinou as biópsias endometriais de mulheres que eram receptoras de transplante de medula óssea, e descobriu que as células derivadas de doadores representavam quase metade das células epiteliais e estromais de suas amostras biopsiadas. Esforços subsequentes para repetir esse estudo encontraram níveis de células doadoras abaixo de 10%, mas o entusiasmo para regenerar o endométrio com terapia celular havia sido aceso. As células-tronco exclusivas do endométrio foram identificadas pela primeira vez em 2004 e têm potencial como uma ferramenta para a medicina regenerativa. Na prática, descobrimos que, até o momento, apenas dois ensaios clínicos afirmam ter aproveitado células-tronco endometriais para o tratamento do revestimento uterino.
No restante deste artigo, vamos nos concentrar nos 49 ensaios clínicos registrados de 2011 a 2020 que empregaram a terapia celular para regenerar o endométrio de mulheres inférteis. Este campo deve sua projeção a um artigo provocativo publicado em 2004 que examinou as biópsias endometriais de mulheres que eram receptoras de transplante de medula óssea, e descobriu que as células derivadas de doadores representavam quase metade das células epiteliais e estromais de suas amostras biopsiadas. Esforços subsequentes para repetir esse estudo encontraram níveis de células doadoras abaixo de 10%, mas o entusiasmo para regenerar o endométrio com terapia celular havia sido aceso. As células-tronco exclusivas do endométrio foram identificadas pela primeira vez em 2004 e têm potencial como uma ferramenta para a medicina regenerativa. Na prática, descobrimos que, até o momento, apenas dois ensaios clínicos afirmam ter aproveitado células-tronco endometriais para o tratamento do revestimento uterino.
Em 2011, foi publicado um relato de caso inovador que descreveu o sucesso da terapia celular para uma mulher com síndrome de Asherman. Na síndrome de Asherman, o revestimento uterino é completamente substituído por tecido fibrótico e aderências. Entre 2% e 22% das mulheres inférteis sofrem de aderências intrauterinas, com variações geográficas dependendo da incidência de doenças e práticas médicas que podem causar lesões no endométrio. O tratamento convencional da síndrome de Asherman é remover as aderências por adesiólise histeroscópica e acompanhar com terapia hormonal. No entanto, cerca de metade das pacientes de Asherman não conseguem engravidar após a terapia convencional. A mulher do relato de caso de 2011 teve suas próprias células-tronco da medula óssea implantadas em sua cavidade uterina durante tratamentos de fertilidade e, após essa intervenção ela engravidou.
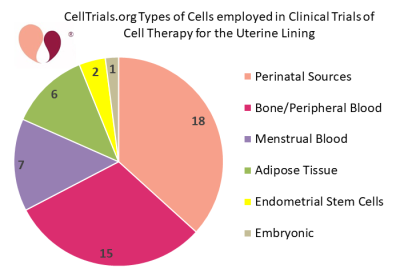 Desde então, vários centros acadêmicos e clínicas de fertilidade vêm incorporando a terapia celular aos tratamentos de fertilidade para mulheres com revestimento uterino fino ou cicatrizado. O segundo gráfico de pizza mostra as categorias de tipos de células que foram empregadas em testes clínicos de terapia celular para o revestimento uterino. A média entre esses ensaios clínicos é de 76 mulheres, com uma faixa de 10 a 500 pacientes. Uma revisão da literatura e meta-análise lançada no final de 2020 descobriu que 8 artigos revisados por pares foram publicados sobre ensaios controlados de terapia celular para tratar a síndrome de Asherman.
Desde então, vários centros acadêmicos e clínicas de fertilidade vêm incorporando a terapia celular aos tratamentos de fertilidade para mulheres com revestimento uterino fino ou cicatrizado. O segundo gráfico de pizza mostra as categorias de tipos de células que foram empregadas em testes clínicos de terapia celular para o revestimento uterino. A média entre esses ensaios clínicos é de 76 mulheres, com uma faixa de 10 a 500 pacientes. Uma revisão da literatura e meta-análise lançada no final de 2020 descobriu que 8 artigos revisados por pares foram publicados sobre ensaios controlados de terapia celular para tratar a síndrome de Asherman.
Estudos clínicos demonstraram que o implante de células-tronco no útero aumenta a espessura do endométrio, de forma estatisticamente significativa, e por um período de tempo prolongado. Assim, o tratamento funciona, independentemente da incerteza sobre o mecanismo de ação. Na verdade, a eficácia dessa terapia celular excede em muito o possível enxerto de células-tronco, o que leva ao argumento de que os efeitos parácrinos devem desempenhar um papel dominante. Isso foi confirmado por grupos que compararam a expressão gênica entre antes e depois das biópsias.
Mas ainda há muito trabalho a ser feito neste campo. Existem enormes variações nas técnicas exatas usadas de um ensaio clínico para outro. Os parâmetros que variam entre os estudos incluem o tipo de células, o processamento das células, a dose celular, os medicamentos e procedimentos cirúrgicos concomitantes, etc. etc. Mesmo os estudos que dependem de células mononucleares (MNC) podem selecionar MNC com marcadores diferentes.
A maioria dos pesquisadores concordaria que o objetivo do transplante de células-tronco no útero é fazer com que fixem residência na camada basal do endométrio, mas as vias específicas de administração usadas para entregar as células também variam amplamente entre os ensaios clínicos. Um método de entrega é infundir as células nas arteríolas espirais, que são pequenas artérias que fornecem sangue ao endométrio. A maioria dos testes injeta as células diretamente no endométrio durante uma histeroscopia. Um método mais elaborado usado por 11 dos 49 ensaios clínicos é carregar as células em algum tipo de matriz (normalmente uma estrutura de colágeno) e, em seguida, transplantar esse pedaço de tecido projetado para o revestimento uterino.
No passado, as mulheres com infertilidade intratável muitas vezes recorriam a mães de aluguel para carregar a gravidez. No entanto, a barriga de aluguel é uma opção muito cara e está repleta de muitas complexidades legais e éticas. Mais países estão proibindo os pais de contratar úteros de substituição de forma comercial. Nessas circunstâncias, a pesquisa sobre a restauração da fertilidade feminina assume uma nova urgência. A terapia celular do revestimento uterino tem o potencial de ser mais barata e mais acessível do que a barriga de aluguel, se puder fazer a transição de ensaios clínicos para terapias aprovadas que são abertas ao público em geral.
References
- Taylor HS. Endometrial cells derived from donor stem cells in bone marrow transplant recipients. JAMA 2004; 292(1):81–85.
- Gargett CE, Schwab KE, Deane JA. Endometrial stem/progenitor cells: the first 10 years. Human Reproduction Update 2016; 22(2):137–163.
- Chan RW, Schwab KE, Gargett CE. Clonogenicity of human endometrial epithelial and stromal cells. Biology of Reproduction 2004; 70(6):1738-1750.
- Nagori CB, Panchal SY, Patel H. Endometrial regeneration using autologous adult stem cells followed by conception by in vitro fertilization in a patient of severe Asherman's syndrome. J Human Reproductive Sciences 2011; 4(1):43-8. [cells from autologous bone marrow]
- Zhao Y, Luo Q, Zhang X, Qin Y, Hao J, Kong D, Wang H, Li G, Gu X, Wang H. Clinical Efficacy and Safety of Stem Cell-Based Therapy in Treating Asherman Syndrome: A System Review and Meta-Analysis. Stem Cells International 2020; 2020:8820538 [review & meta-analysis]
- Singh N, Mohanty S, Seth T, Shankar M, Dharmendra S, Bhaskaran S. Autologous stem cell transplantation in refractory Asherman's syndrome: a novel cell based therapy. J Human Reproductive Sciences 2014; 7(2):93–98. [cells from autologous bone marrow]
- Santamaria X, Cabanillas S, Cervelló I, Arbona C, Raga F, Ferro J, et al. Autologous cell therapy with CD133+bone marrow-derived stem cells for refractory Asherman's syndrome and endometrial atrophy: A pilot cohort study. Human Reproduction 2016; 31(5):1087–1096. [cells from autologous apheresis]
- Tan J, Li P, Wang Q, Li Y, Li X, Zhao D, Xu X, Kong L. Autologous menstrual blood-derived stromal cells transplantation for severe Asherman's syndrome. Human Reproduction 2016; 31(12):2723–2729. [cells from menstrual blood]
- Zhao G, Cao Y, Zhu X. et al. Transplantation of collagen scaffold with autologous bone marrow mononuclear cells promotes functional endometrium reconstruction via downregulating ΔNp63 expression in Asherman's syndrome. Science China Life Sciences 2017; 60(4):404–416. [cells from autologous bone marrow]
- Cao Y, Sun H, Zhu H. et al. Allogeneic cell therapy using umbilical cord MSCs on collagen scaffolds for patients with recurrent uterine adhesion: a phase I clinical trial. Stem Cell Research & Therapy 2018; 9:192 [umbilical cord MSC]
- Azizi R, Aghebati-Maleki L, Nouri M, Marofi F, Negargar S, Yousefi M. Stem cell therapy in Asherman syndrome and thin endometrium: Stem cell- based therapy. Biomedicine & Pharmacotherapy 2018; 102:333-343. [review]
- Lee SY, Shin JE, Kwon H, Choi DH, Kim JH. Effect of autologous adipose-derived stromal vascular fraction transplantation on endometrial regeneration in patients of Asherman's syndrome: a pilot study. Reproductive Sciences 2020; 27(2):561–568. [autologous adipose SVF]
- Ma H, Liu M, Li Y. et al. Intrauterine transplantation of autologous menstrual blood stem cells increases endometrial thickness and pregnancy potential in patients with refractory intrauterine adhesion. J Obstetrics Gynaecology Research 2020; 46(11):2347–2355. [cells from menstrual blood]
- Singh N, Shekhar B, Mohanty S, Kumar S, Seth T, Girish B. Autologous Bone Marrow-Derived Stem Cell Therapy for Asherman's Syndrome and Endometrial Atrophy: A 5-Year Follow-up Study. J Human Reproductive Sciences 2020; 13(1):31-37. [cells from autologous bone marrow]
- de Miguel-Gómez L, Ferrero H, López-Martínez S, Campo H, López-Pérez N, Faus A, Hervás D, Santamaría X, Pellicer A, Cervelló I. Stem cell paracrine actions in tissue regeneration and potential therapeutic effect in human endometrium: a retrospective study. BJOG 2019; 127(5):551-560.
- Bagri/Anand NT. A Controversial Ban on Commercial Surrogacy Could Leave Women in India With Even Fewer Choices. TIME Magazine Published 2021-06-30