Jesteś tutaj
Уроки, извлеченные из COVID-19 биобанками
Краткое изложение уроков, извлеченных из COVID-19 для биобанков:
|
Этот пост основан на публикации от июня 2023 года, подготовленной совместно командой CellTrials.org, доктором Гвидо Моллом и командой из Медицинского университета Шарите в Берлине (Германия), а также профессором Отавио Кабрал-Маркесом и командой из Университета Сан-Паулу в Бразилии. В документе собраны клинические испытания передовой клеточной терапии COVID-19, сопоставлены опубликованные результаты испытаний и проведен метаанализ эффективности лечения COVID-19 с помощью инфузий мезенхимальных стромальных клеток (МСК)1. На сегодняшний день это крупнейший метаанализ терапии МСК при COVID-19, основанный на предыдущих исследованиях клинических рекомендаций внутривенной терапии продуктами МСК2-4. Мы обнаружили, что МСК обеспечивают относительное снижение риска смертности от всех причин COVID-19 на уровне RR=0,63 [95% ДИ от 0,46 до 0,85]1.
В этом посте мы резюмируем другой аспект статьи: демографические данные клинических испытаний и их значение для индустрии биобанкинга. Во время пандемии коронавируса местные биобанки сыграли решающую роль в качестве поставщиков продуктов клеточной терапии в то время, когда международные пути доставки были нарушены.
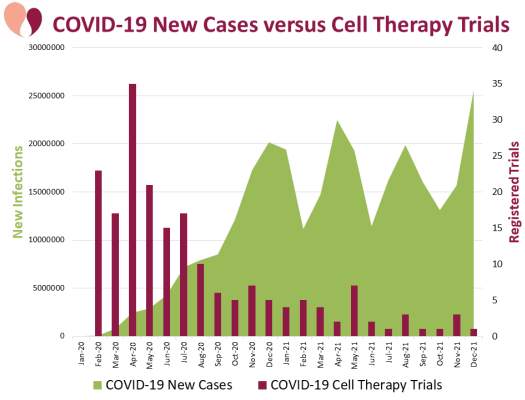 За двухлетний период с января 2020 года по декабрь 2021 года в 18 международных реестрах было зарегистрировано 195 клинических исследований клеточной терапии COVID-19. Количество исследований, зарегистрированных за месяц в течение этого периода, показывает, что в апреле 2020 года был мощный пик, который к осени 2020 года сменился длинным периодом из нескольких исследований в месяц. За два года (2020 и 2021 годы) во всем мире произошло четыре всплеска инфекций, вызванных вариантами COVID-19. Крупный всплеск заболеваемости начался ближе к концу 2020 года, когда испытания клеточной терапии уже прошли несколько месяцев после своего пика. Наша команда — единственная, кто так подробно нарисовал график испытаний клеточной терапии COVID-19 за столь длительный период времени. Наши данные показывают, что регистрация исследований не была обусловлена распространенностью заболевания. Регистрация исследований, скорее всего, основывалась на том, имели ли ведущие исследователи доступ к продукту клеточной терапии с уже установленным профилем безопасности, который можно было бы использовать в качестве потенциальной терапии COVID-19. Мы продолжили мониторинг испытаний, выходящих за рамки опубликованного документа, и можем сообщить, что тенденция проведения нескольких исследований в месяц продолжалась в течение 2022 года, включая начало 2023 года.
За двухлетний период с января 2020 года по декабрь 2021 года в 18 международных реестрах было зарегистрировано 195 клинических исследований клеточной терапии COVID-19. Количество исследований, зарегистрированных за месяц в течение этого периода, показывает, что в апреле 2020 года был мощный пик, который к осени 2020 года сменился длинным периодом из нескольких исследований в месяц. За два года (2020 и 2021 годы) во всем мире произошло четыре всплеска инфекций, вызванных вариантами COVID-19. Крупный всплеск заболеваемости начался ближе к концу 2020 года, когда испытания клеточной терапии уже прошли несколько месяцев после своего пика. Наша команда — единственная, кто так подробно нарисовал график испытаний клеточной терапии COVID-19 за столь длительный период времени. Наши данные показывают, что регистрация исследований не была обусловлена распространенностью заболевания. Регистрация исследований, скорее всего, основывалась на том, имели ли ведущие исследователи доступ к продукту клеточной терапии с уже установленным профилем безопасности, который можно было бы использовать в качестве потенциальной терапии COVID-19. Мы продолжили мониторинг испытаний, выходящих за рамки опубликованного документа, и можем сообщить, что тенденция проведения нескольких исследований в месяц продолжалась в течение 2022 года, включая начало 2023 года.
Среди этих 195 клинических испытаний современной клеточной терапии COVID-19 было протестировано 204 типа клеточных продуктов, поскольку в некоторых исследованиях использовались клетки нескольких типов. В нашей статье эти продукты клеточной терапии характеризуются различными аспектами в их производстве и клиническом применении, но двумя наиболее примечательными показателями являются высокая доля аллогенных продуктов и высокая доля продуктов МСК. Во-первых, донорские клетки использовали в 76% исследований, аутологичные - в 11% и неизвестного происхождения - в 13%. Таким образом, по крайней мере в трёх четвертях исследований для пациентов с COVID-19 использовались продукты клеточной терапии, полученные от здоровых доноров. Во-вторых, это очень похоже на долю исследований с использованием MSC, которая составила 72%. В совокупности эти факты показывают, что многие клиницисты, стремившиеся предложить передовые клеточные методы лечения своим пациентам с COVID-19, полагались на доступ к биобанку, производящему аллогенные МСК или аллогенные иммунотерапевтические препараты. Также решающее значение для лечения пациентов имело наличие криогенного хранения клеток и логистическая цепочка, которая могла бы своевременно доставлять клеточные препараты из ранее замороженных, либо только что произведенных клеток5.
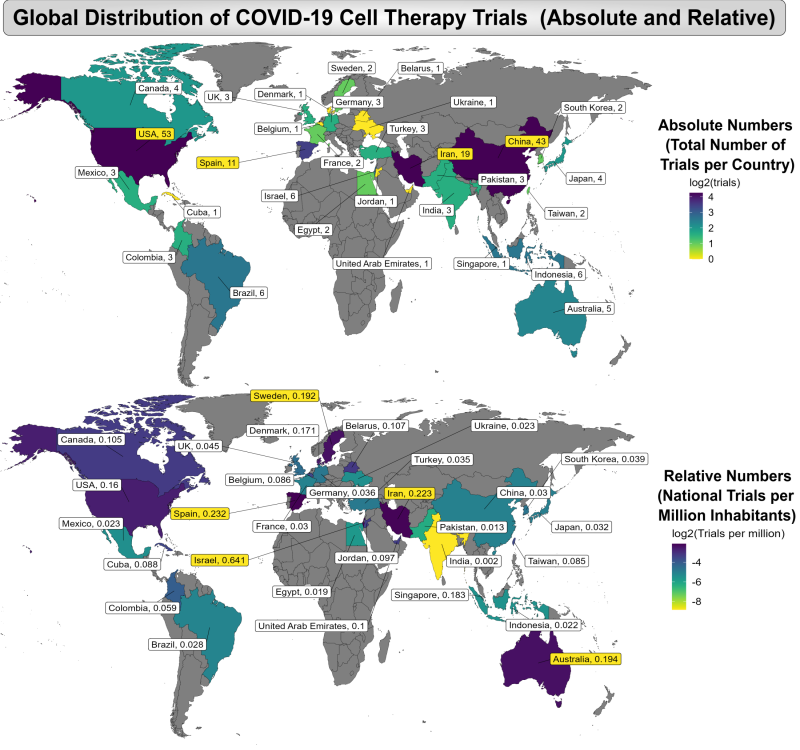
Мы обнаружили, что пандемия COVID-19 оказала демократизирующее влияние на усилия по клеточной терапии. Мы подготовили глобальные тепловые карты стран, где проводились клинические испытания современной клеточной терапии COVID-19, независимо от того, где они были зарегистрированы. Только одно исследование состоялось более чем в одной стране. Верхняя карта отображает количество исследований на страну, а нижняя карта отображает количество исследований на миллион жителей страны. Первый удивительный факт, связанный с картами, заключается в том, что за этот двухлетний период были зарегистрированы клинические испытания клеточной терапии COVID-19 в 30 странах. Лидерами по количеству исследований были США (53), Китай (43), Иран (19) и Испания (11), но в них также приняли участие многие страны, которые обычно не считаются центрами исследований в области клеточной терапии. Более подробную информацию можно получить из второй карты регистрации исследований на душу населения, где лидерами являются Израиль (0,641), Испания (0,232), Иран (0,223), Австралия (0,194) и Швеция (0,192). Наше исследование стало единственной подборкой исследований клеточной терапии COVID-19, в ходе которой был проведен тщательный поиск в иранском реестре исследований и сообщалось об активном участии Ирана либо в количестве исследований, либо в относительном количестве исследований клеточной терапии COVID-19 на душу населения.
Мы считаем, что самый большой урок, извлеченный из демографических данных передовой клеточной терапии COVID-19, заключается в критической важности местных биобанков, которые могли бы быстро предоставлять аллогенную клеточную терапию тяжелобольным пациентам. Клиницисты, которые хотели лечить своих пациентов с COVID-19 с помощью клеточной терапии, нуждались не только в источниках ранее протестированных клеточных продуктов, но также в источниках, к которым они могли бы получить доступ в то время, когда многие границы были закрыты. Специалисты различных медицинских специальностей обсудили важность извлечения уроков из Covid-19, чтобы мы могли добиться большего успеха во время следующей пандемии. В области клеточной терапии важным уроком, который следует усвоить, является то, что каждая страна должна развивать местную индустрию биобанков. Поскольку все больше продуктов клеточной терапии получают одобрение регулирующих органов, необходимо создавать распределительные сети с несколькими центрами хранения, чтобы, в случае пандемии и закрытых границ, обеспечить попадание продуктов, производимых в центральной лаборатории, к пациентам.
Рекомендации:
- Pedro Silva Couto, Al-Arawe N, Filgueiras IS, Fonseca DLM, Hinterseher I, Catar RA, Chinnadurai R, Bersenev A, Cabral-Marques O, Guido Moll & Frances Verter (June 2023) Systematic Review and Meta-Analysis of Cell Therapy for COVID-19: Global Clinical Trial Landscape, Published Safety / Efficacy Outcomes, Cell Product Manufacturing and Clinical Delivery. Frontiers Immunology 14:1200180.
- Moll G, et al. Intravascular Mesenchymal Stromal/Stem Cell Therapy Product Diversification: Time for New Clinical Guidelines. Trends Mol Med 2019; 25(2):149-163.
- Moll G, et al. MSC Therapies for COVID-19: Importance of Patient Coagulopathy, Thromboprophylaxis, Cell Product Quality and Mode of Delivery for Treatment Safety and Efficacy. Frontiers Immunology 2020; 11:1091.
- Moll G, Ankrum JA, Olson SD, & Nolta JA. Improved MSC Minimal Criteria to Maximize Patient Safety: A Call to Embrace Tissue Factor and Hemocompatibility Assessment of MSC Products. Stem Cells Translational Medicine 2022; 11:2-13.
- Cottle C, Porter AP, Lipat A, et al. Impact of Cryopreservation and Freeze-Thawing on Therapeutic Properties of Mesenchymal Stromal/Stem Cells and Other Common Cellular Therapeutics. Curr Stem Cell Rep 2022; 8:72–92.