Usted está aquí
Терапия пуповинной кровью при рассеянном склерозе
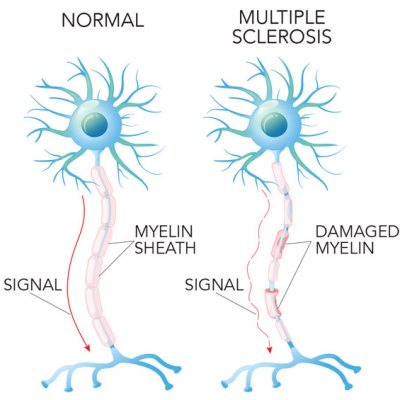 Рассеянный склероз (РС) – это аутоиммунное заболевание, при котором иммунная система пациента атакует миелиновые оболочки, которые окружают и защищают нервные волокна в центральной нервной системе1. Области поврежденного миелина выявляются как поражения на МРТ головного и спинного мозга. Эти поражения нарушают нервные сигналы от мозга к другим частям тела. Симптомы могут быть очень разными, но обычно включают усталость и нарушение координации движений. Около миллиона человек в США живут с РС, чаще всего он встречается у женщин, чем у мужчин2.
Рассеянный склероз (РС) – это аутоиммунное заболевание, при котором иммунная система пациента атакует миелиновые оболочки, которые окружают и защищают нервные волокна в центральной нервной системе1. Области поврежденного миелина выявляются как поражения на МРТ головного и спинного мозга. Эти поражения нарушают нервные сигналы от мозга к другим частям тела. Симптомы могут быть очень разными, но обычно включают усталость и нарушение координации движений. Около миллиона человек в США живут с РС, чаще всего он встречается у женщин, чем у мужчин2.
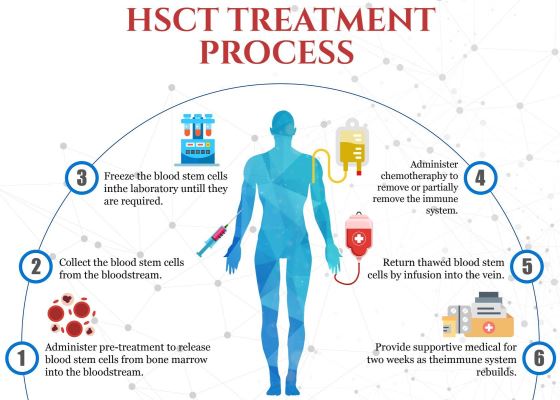
TТрансплантация гемопоэтических или кроветворных стволовых клеток (ТГСК) стала общепринятым лечением некоторых форм рассеянного склероза (РС). Это большой прогресс с тех пор, как мы в последний раз освещали эту болезнь в одной из статей нашего информационного бюллетеня в 2016 году3. В то время в нескольких клинических испытаниях были опубликованы первые положительные результаты для пациентов, перенесших трансплантацию собственного (аутологичного) костного мозга для лечения рецидивирующе-ремиттирующего РС. В одном из исследований Северо-Западного университета США, включающего 151 пациента с рассеянным склерозом, через четыре года у 87% не было прогрессирования заболевания4. Анализ клеток крови пациентов с РС, получавших ТГСК, подтвердил, что свойства Т-клеток их иммунной системы были фактически сброшены до менее аутореактивного состояния5.
В октябре 2020 года Национальное общество рассеянного склероза США официально рекомендовало аутологичную ТГСК для определенных групп пациентов с рассеянным склерозом. Позже рекомендация была опубликована в специальном сообщении для журнала Американской медицинской ассоциации. Национальное общество рассеянного склероза заявляет, что пациенты с рецидивирующим РС являются кандидатами на аутологичную ТГСК, если они: моложе 50 лет, длительность их заболевания менее 5-10 лет, все еще находятся в амбулаторных условиях и у них возникают обострения РС, несмотря на лечение традиционными методами.
Актриса Сельма Блэр сообщила в августе 2021 года, что ей сделали трансплантацию стволовых клеток для лечения тяжелой вспышки рассеянного склероза, и сейчас она находится в стадии ремиссии7. Документальный фильм о ее жизни «Знакомство с Сельмой Блэр» вышел в эфир на сплатформе Discovery 21 октября. Это, вероятно, приведет к тому, что больше известных людей расскажут о своей борьбе с РС.
Следует подчеркнуть, что в настоящее время ТГСК не стала стандартным лечением рассеянного склероза. FDA одобрило ряд лекарств от рассеянного склероза, которые считаются высокоэффективными «модифицирующими заболевание терапиями» (DMT), они являются терапией первой линии8. Хотя метаанализ показывает, что ТГСК лучше, чем ДМТ, в плане достижения длительных ремиссий, эту эффективность необходимо уравновешивать с рисками, связанными с ТГСК6. Чтобы лучше понять, каких пациентов с РС следует рассматривать для ТГСК, Национальный институт аллергии и инфекционных заболеваний спонсирует клиническое испытание под названием «Лучшая доступная терапия в сравнении с трансплантацией аутологичных гемопоэтических стволовых клеток при рассеянном склерозе (BEAT-MS)», которое в настоящее время находится на стадии подбора пациентов, NCT04047628. Еще одно преимущество ТГСК для тех пациентов, которые соответствуют критериям - это значительно более низкая стоимость, чем пожизненное лечение лекарствами ДМТ6.
Последней разработкой в области клеточной терапии РС является клиническое испытание NCT04943289, зарегистрированное в июне 2021 года, в котором планируется лечить прогрессирующий РС продуктом из пуповинной крови DUOC-01. Исследования по использованию DUOC-01 для лечения рассеянного склероза насчитывают более четверти века. В 1990-х годах группа доктора Курцберг в Университете Дьюка впервые применила трансплантацию пуповинной крови для лечения детей с наследственными нарушениями обмена веществ. Определенные врожденные нарушения метаболизма, называемые лейкодистрофиями, включая глобоидную лейкодистрофию (болезнь Краббе), метахроматическую лейкодистрофию, адренолейкодистропию и другие, приводят к аномальной миелинизации или потере миелинизации в центральной и периферической нервной системе. Группа доктора Курцберга смогла показать, что трансплантация пуповинной крови может исправить метаболический дефект у этих пациентов, продлить жизнь, а в некоторых случаях предотвратить прогрессирование их болезни9. У некоторых детей наблюдались ощутимые улучшения нейрокогнитивной функции9.
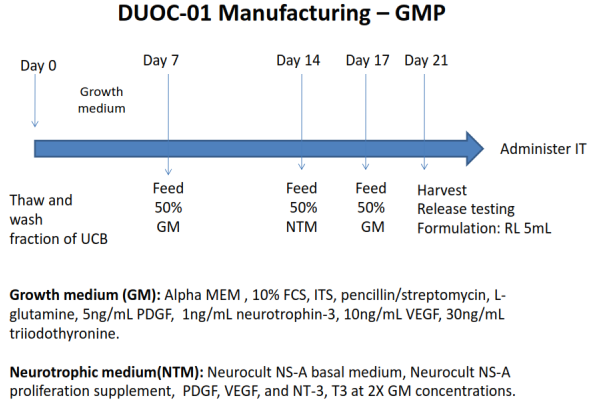
Последующие исследования в Duke были направлены на идентификацию специфических клеток в пуповинной крови, которые способствовали ремиелинизации нервных оболочек. Было определено, что активные клетки происходят из моноцитов CD14+ пуповинной крови. Их можно выращивать в закрепленной клеточной культуре в фагоцитарные клетки, которые способны стимулировать пролиферацию олигодендроцитов, клеток, вырабатывающих миелин. В начале 2010 года доктор Курцберг назвала активные клетки пуповинной крови «О-клетками», потому что они действовали как олигодендроциты. Название продукта «DUOC» возникло как сочетание «Duke University» и «O-Cell». Однако последующие исследования описали клетки как имеющие «характеристики макрофагов и микроглии»10-15. Процесс изготовления препарата DUOC-01 занимает три недели. В 2014 году в рамках клинического исследования NCT02254863 началось лечение детей с диагнозом демиелинизирующие метаболические нарушения с использованием комбинации трансплантатов пуповинной крови и DUOC-01. Для этого исследования пациенты продолжают набираться.
Долгосрочная цель исследований DUOC всегда заключалась в разработке автономной клеточной терапии демиелинизирующих заболеваний у взрослых. Но перед запуском такого клинического испытания необходимо было преодолеть множество препятствий. Два исследования были проведены на животных моделях РС, чтобы продемонстрировать, что DUOC-01 ускоряет ремиелинизацию, снижает глиоз и уменьшает клеточную инфильтрацию в головном мозге16,17. Процесс производства клеток DUOC постепенно улучшается. В настоящее время доза для каждого пациента производится из одной единицы донорской пуповинной крови, частично соответствующей HLA. Лаборатория Курцберг изучает модификации производственного процесса, которые позволят увеличить количество клеток DUOC из одной единицы пуповинной крови18, а также изучают новые способы оценки ремиелинизации19. Испытание NCT04943289 DUOC-01 для рассеянного склероза основано на интратекальной доставке клеток, представляющую собой инъекцию в спинномозговую жидкость, безопасность процедуры была доказана в предыдущем исследовании NCT02254863 DUOC-01 у детей. Очень важно отметить, что исследование DUOC-01 для РС нацелено на пациентов с первично-прогрессирующей формой заболевания, а не на группу пациентов с ремиттирующим РС, которая соответствует критериям для аутологичной ТГСК.
Неудивительно, что Университет Дьюка и изобретатели DUOC-01 подали заявку на серию патентов, последний из которых был подан в мае 2011 года15. Потенциально, DUOC-01 может применяться при других дегенеративных состояниях, вызывающих демиелинизацию центральной нервной системы (ЦНС), а также при вызванной травмой демиелинизации ЦНС. Заявка на патент явно распространяется на рассеянный склероз, повреждение спинного мозга, повреждение периферических нервов, болезнь Паркинсона, боковой амиотрофический склероз (БАС) и болезнь Альцгеймера.
Наконец, DUOC-01 является благом для государственных банков пуповинной крови, потому что он производится из криоконсервированной донорской пуповинной крови.
References
- National Multiple Sclerosis Society. What is MS? Accessed 2021-10-01
- National Multiple Sclerosis Society. Who gets MS? Accessed 2021-10-01
- Verter F. Stem Cell Therapies for AutoImmune Diseases such as Multiple Sclerosis. Parent's Guide to Cord Blood Foundation Newsletter Published 2016-04
- Burt RK, Balabanov R, Han X, Sharrack B, Morgan A, Quigley K, Yaung K, Helenowski IB, Jovanovic B, Spahovic D, Arnautovic I, Lee DC, Benefield BC, Futterer S, Oliveira MC, Burman J.Association of nonmyeloablative hematopoietic stem cell transplantation with neurological disability in patients with relapsing-remitting multiple sclerosis. JAMA 2015; 313(3):275-284.
- Muraro PA, Robins H, Malhotra S, Howell M, Phippard D, Desmarais C, Sousa AdPA, Griffith LM, Lim N, Nash RA, Turka LA. T cell repertoire following autologous stem cell transplantation for multiple sclerosis. J Clinical Investigation 2014; 124(3):1168-1172.
- Miller AE, Chitnis T, Cohen BA, Costello K, Sicotte NL, Stacom R, and the National Medical Advisory Committee of the National Multiple Sclerosis Society. Autologous Hematopoietic Stem Cell Transplant in Multiple Sclerosis. Recommendations of the National Multiple Sclerosis Society. JAMA Neurology 2021; 78(2):241-246.
- Mazziotta J, Dugan C. Selma Blair Is 'In Remission' from Her Multiple Sclerosis: 'My Prognosis Is Great'. People Magazine Published 2021-08-16
- National Multiple Sclerosis Society. Medications Accessed 2021-10-01
- Prasad VK, Mendizabal A, Parikh SH, Szabolcs P, Driscoll TA, Page K, Lakshminarayanan S, Allison J, Wood S, Semmel D, Escolar ML, Martin PL, Carter S, Kurtzberg J. Unrelated donor umbilical cord blood transplantation for inherited metabolic disorders in 159 pediatric patients from a single center: influence of cellular composition of the graft on transplantation outcomes. Blood 2008; 112(7):2979-2989
- Tracy E, Aldrink J, Panosian J, Beam D, Thacker J, Reese M, Kurtzberg J. Isolation of oligodendrocyte-like cells from human umbilical cord blood. Cytotherapy 2008; 10(5):518-d25.
- Tracy ET, Zhang CY, Gentry T, Shoulars KW, Kurtzberg J. Isolation and expansion of oligodendrocyte progenitor cells from cryopreserved human umbilical cord blood. Cytotherapy 2011; 13(6):722-729.
- Kurtzberg J, Buntz S, Gentry T, Noeldner P, Ozamiz A, Rusche B, Storms RW, Wollish A, Wenger DA, Balber AE. Preclinical characterization of DUOC-01, a cell therapy product derived from banked umbilical cord blood for use as an adjuvant to umbilical cord blood transplantation for treatment of inherited metabolic diseases. Cytotherapy 2015; 17(9):1314-1326.
- Saha A, Buntz S, Scotland P, Xu L, Noeldner P, Patel S, Wollish A, Gunaratne A, Gentry T, Troy J, Matsushima GK, Kurtzberg J, Balber AE. A cord blood monocyte-derived cell therapy product accelerates brain remyelination. JCI Insight 2016; 1(13):e86667.
- Scotland P, Buntz S, Noeldner P, Saha A, Gentry T, Kurtzberg J, Balber AE. Gene products promoting remyelination are up-regulated in a cell therapy product manufactured from banked human cord blood. Cytotherapy 2017; 19(6):771-782.
- COMPOSITIONS AND METHODS FOR THE TREATMENT OF DEMYELINATING CONDITIONS. Patent Application: 17/328,749 Filed: 2021-05-24 Publication: 2021-09-09
- Saha A, Buntz S, Patel S, Matsushima GK, Wollish A, Kurtzberg J, Balber A. DUOC-01, a candidate cell therapy product derived from banked cord blood, accelerates brain remyelination in NSG mice following cuprizone feeding. Cytotherapy 2014; 16(4):S61-S62.
- Saha A, Scotland P, Parrott R, ... Xu L, Filiano AJ, Kurtzberg J. DUOC-01, a cord blood derived cell therapy product, ameliorates experimental autoimmune encephalomyelitis, a murine model for multiple sclerosis. Cytotherapy ISCT Abstracts 2020; 22(5):S31-S32.
- Xu L, Parrott R, French M, Kurtzberg J, Filiano A. Optimizing the Production of a Human Umbilical Cord Blood-Derived Cell Therapy Product, DUOC-01. Stem Cells Translational Medicine 2021; 10(S1):S4.
- Zhang L, Ellor S, Sun JM, Liu C, Kurtzburg J, Song AW. DTI Tract-Based Quantitative Susceptibility Mapping: An Initial Feasibility Study to Investigate the Potential Role of Myelination in Brain Connectivity Change in Cerebral Palsy Patients During Autologous Cord Blood Cell Therapy Using a Rotationally-Invariant Quantitative Measure. J Magn Reson Imaging 2021; 53(1):251–258.